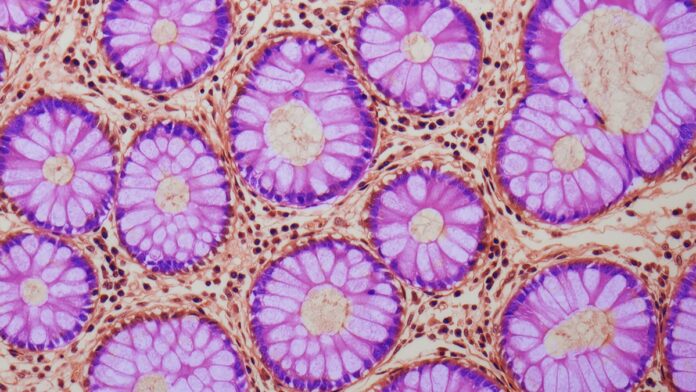
Nieuw onderzoek suggereert dat leeftijdsgebonden veranderingen in darmstamcellen, met name een proces dat Aging and Colon Cancer-Associated (ACCA) drift wordt genoemd, een sleutelfactor kunnen zijn in het toenemende risico op colorectale kanker naarmate mensen ouder worden. De studie, uitgevoerd door een internationaal team, laat zien hoe subtiele verschuivingen in DNA-markeringen – niet het DNA zelf, maar hoe het wordt gelezen – genen die beschermen tegen tumorvorming geleidelijk tot zwijgen kunnen brengen.
Hoe epigenetische drift werkt
Het onderzoek benadrukt dat ACCA-drift geen plotselinge gebeurtenis is; het is een langzame accumulatie van epigenetische veranderingen. Deze veranderingen omvatten veranderingen in de DNA-methylatie, die werkt als een schakelaar die de genactiviteit controleert. Na verloop van tijd verstoren ontstekingen, verminderde groeisignalering en lage ijzerniveaus in darmstamcellen het systeem dat deze markeringen in stand houdt. Dit leidt tot het uitschakelen van cruciale tumoronderdrukkende genen, waardoor kwetsbare plekken in de darmwand ontstaan.
De gevarenzones beginnen in de darmcrypten, kleine zakjes in de darmen waar stamcellen het weefsel vernieuwen. Terwijl deze crypten zich verdelen, verspreiden de oudere, kankergevoelige epigenetische profielen zich, waardoor gebieden met een verhoogd risico langzaam groter worden. Dit proces gebeurt niet van de ene op de andere dag; het stapelt zich in de loop van de jaren op, waardoor vroege detectie moeilijk wordt.
Waarom dit belangrijk is
Het aantal colorectale kankers neemt toe met de leeftijd, en deze studie biedt een biologische verklaring voor die trend. Het suggereert dat de darmen niet alleen in de loop van de tijd kwetsbaarder worden, maar actief veranderen op een manier die de kans op kanker vergroot. De belangrijkste conclusie is dat epigenetische drift niet noodzakelijkerwijs een vast lot is; het kan worden beïnvloed.
De drift omkeren?
Experimenten met organoïden (mini-ingewanden gekweekt in laboratoria) laten veelbelovende resultaten zien. Het stimuleren van de ijzeropname of het herstellen van celgroeisignalen zou de epigenetische drift kunnen vertragen en zelfs gedeeltelijk omkeren. Dit suggereert mogelijke interventies om het proces te vertragen of te voorkomen.
“Dit betekent dat epigenetische veroudering geen vaststaand eindpunt hoeft te zijn”, zegt moleculair bioloog Anna Krepelova. “Voor het eerst zien we dat het mogelijk is om de parameters van veroudering, die diep in de moleculaire kern van de cel liggen, aan te passen.”
Deze bevindingen bieden een nieuw inzicht in hoe kanker zich ontwikkelt en suggereren dat het richten op epigenetische mechanismen een haalbare strategie kan zijn om het risico te verminderen. De volgende stap is om te bepalen hoe deze interventies zich vertalen naar de mens en of ze kunnen worden geïntegreerd in preventieve maatregelen.